Caratterizzazione chimica Psilocybe
CHIMICA PSILOCYBE – ALCALOIDI
Gruppo 1 – Indolici
Psilocibina
Principale alcaloide e profarmaco psicoattivo, dopo l’ingestione le fosfatasi, enzimi del fegato e dell’intestino, rimuovono il gruppo fosfato dalla molecola convertendola in psilocina. Mostra affinità debolissima per i recettori serotoninergici in vitro [1].
Psilocina
Ha circa 1,3–1,5 volte la potenza della psilocibina a parità di dose, la sua azione psicotropa è mediata principalmente dai recettori 5-HT2A e 5-HT1A della serotonina.
Baeocistina
Analogico N-metilato della psilocibina, il chimico e micologo tedesco Jochen Gartz ha riportato che avesse una potenza simile alla psilocibina nei suoi esperimenti [2], poi riprodotti con successo anche da Jonathan Ott [3]. Tuttavia altri autori hanno dichiarato che fosse invece inattiva o comunque priva di potenziale psichedelico. Nei ratti non ha mostrato alcun effetto psicotropo, avendo una bassa permeabilità che impedisce la penetrazione efficace attraverso la barriera ematoencefalica (BBB) [4].
Norbaeocistina
Analogico demetilato della baeocistina e profarmaco per 4-idrossitriptamina (4-HT). Non induce effetti psicotropi sulle cavie [5]. Nei modelli animali ha mostrato effetti antidepressivi simili alla fluoxetina [6].
4-Idrossitriptamina
Analogo defosforilato della norbaeocistina, come l’altro alcaloide è un agonista 5-HT2A ma non ha effetti psichedelici [5].
Norpsilocina
Analogico defosforilato della baeocistina E’ un agonista completo 5-HT2a ma, come l’altro alcaloide, non ha buone capacità di penetrazione della BBB e manca di potenziale psichedelico. Negli animali ha indotto effetti periferici simili alla psilocina ( come riduzione dell’attività serotoninergica, aumento di frequenza cardiaca e pressione arteriosa) ma anche opposti (riduzione dei riflessi spinali) [4]. E’ attualmente sotto studio con il nome di PLZ-1017 per il trattamento dei disturbi dello spettro autistico nei bambini.
Aeruginascina
Analogo N-trimetilato della psilocibina, Gartz ha ipotizzato che avesse un’importante componente euforizzante comparando gli effetti delle intossicazioni di Inocybe aeruginascens, ricco di aeruginascina, con quelli dei normali funghi psilocibinici [7]. Ma in assenza di un vero studio comparativo le affermazioni rimangono aneddotiche e preliminari. Non ha indotto effetti psichedelici sulle cavie, solo depressione del CNS ed abbassamento della temperatura.
Alcuni autori hanno ipotizzato che possa essere il composto responsabile dei fenomeni di paralisi temporanea indotta da alcune specie lignicole di Psilocybe, ma ad oggi la questione è molto controversa [8].
4-HO-TMT
Derivato defosforilato dell’aeruginascina, come l’altro alcaloide ha scarsa capacità di penetrazione della BBB ed ha indotto sedazione ed ipotermia nelle cavie [9].
Gruppo 2 – Betacarboline
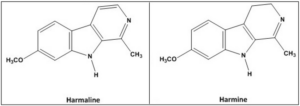
Armano
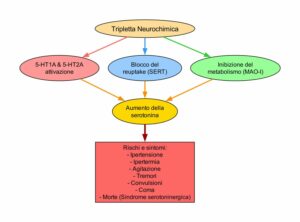
Alcaloide presente in diversi cibi e nel fumo di tabacco, ha proprietà MAO-Inibitorie e tremorgeniche [10]. Insieme agli altri derivati betacarbolinici degli Psilocybe potrebbe influenzare il metabolismo di psilocibina e le altre triptamine, ma sono tutti presenti in basse concentrazioni e non sappiamo se siano farmacologicamente rilevanti o meno.
Armina
Principale alcaloide di Banisteriopsis caapi e Peganum harmala, è un potente inibitore del MAO-A.
Cordisinine
Betacarboline di cui sono note solo le proprietà antinfiammatorie ed antitumorali [11].
Perlolirina
Non sappiamo se questa betacarbolina presente anche in diversi alimenti abbia proprietà MAO-inibitorie o effetti psicotropi di qualche tipo, è nota solo la sua azione chemopreventiva ed antiproliferativa [12].
Gruppo 3 – Protoalcaloidi
Fenitilammina
Si tratta di un ammina che viene prodotta anche a livello endogeno ed agisce come un stimolante del sistema nervoso legandosi a recettore delle ammine traccia TAAR1 e trasportatore vescicolare VMAT2 nei neuroni. In vitro ha circa la stessa potenza dell’anfetamina ma non è attiva oralmente se l’enzima MAO-B non viene inibito [13].
CHIMICA PSILOCYBE – TERPENOIDI
Acido ent-16β,17-diidrossi-kauran-19-oico
Un diterpene che ha dimostrato di contrastare il virus dell’HIV [14].
14α,16-epossi-18-norisopimar-7-en-4α-olo
Un diterpene dalle proprietà immunosoppressive [15].
Acido ent-12α,16β,17-triidrossi-kauran-19-oico e ent-11α,16β,17-triidrossi-kauran-19-oico
Altri due diterpeni antitumorali [16].
CHIMICA PSILOCYBE – ATRI COMPOSTI ORGANICI
Verpecamide
Un ciclopeptide di cui sono note le proprietà antinfiammatorie ed antitumorali [17].
Lumicromo
un derivato della riboflavina di cui sono note le proprietà antitumorali ed antivirali [18]. Agisce anche come segnalatore batterico nella rizosfera, l’area di terriccio che circonda le radici, stimolando la crescita della pianta [19].
Neochinuline
Composti organici di cui è nota l’azione antidepressiva, antinfiammatoria, neuroproettiva ed antivirale [20].
Emodina
Isolata da Psilocybe merdaria, agisce come lassativo, antisettico e anticancerogeno [21].
CHIMICA PSILOCYBE – COMPOSTI FENOLICI
Isodiidroauroglaucina
Un composto aromatico attivo contro Streptococcus pneumoniae [22].
Psilosamuiensine
Sesquiterpeni dalla farmacologia ancora ignota.
(S)-4-(4-metilpent-3-en1-il)-butirolattone
Un monoterpene dalla farmacologia ignota.
Flavoglaucina, chaetopyranina, acido α-furoico, acido 1,2,3-propanotricarbossilico e 2-idrossi-1,2,3-trietil estere
Composti fenolici dalla farmacologia ignota.
FONTI
2)Gartz, Jochen. Further investigations on psychoactive mushrooms of the genera Psilocybe, Gymnopilus and Conocybe. 1992.
2)Ott, Jonathan. PHARMACOTHEON Entheogenzc drugs, their plant sources and history. 1993.
QUEST’ARTICOLO VUOLE SOLO EDUCARE SULLA CHIMICA DEI FUNGHI PSILOCYBE, NON INCORAGGIARNE IL CONSUMO.